국내 기업중 우스테키누맙 최대 시장인 미국에서 허가를 받은 곳은 아직 없다. 하지만 생산시설 실사 진행을 거쳐 국내기업도 빠르면 연내에 허가를 받을 수 있을 거란 기대감도 나온다.
20일 업계에 따르면 스텔라라 바이오시밀러를 개발 중인 삼성바이오에피스‧셀트리온‧동아에스티는 모두 주요 시장인 미국 식품의약국(FDA)에 품목허가를 신청한 상태다.
스텔라라는 얀센(현 J&J 이노베이티브 메디슨)이 개발한 건선, 크론병, 궤양성 대장염 등 자가면역질환 치료제다. 의약품 시장조사기관 아이큐비아(IQVIA)에 따르면 지난해 스텔라라 글로벌 매출은 약 14조 원, 국내 매출은 500억 원으로 나타났다.
지난해 9월 미국에서 스텔라라의 물질 특허가 만료된 데 이어 올해 7월 유럽에서도 만료 예정이어서 다수의 글로벌 제약사가 바이오시밀러 개발에 나서고 있다.
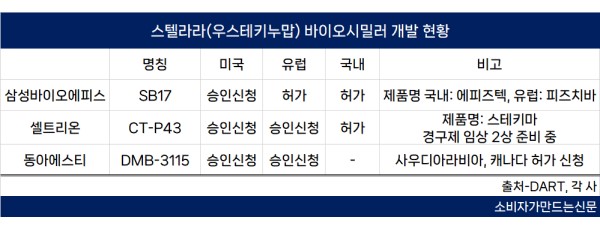
SB17의 글로벌 판권은 스위스 제약사 산도스가 갖고 있다. 올해 하반기 유럽 물질특허 만료 시기에 맞춰 출시할 예정이다. 국내에서는 직접 판매할 계획이다.
삼성바이오에피스 관계자는 “산도스가 글로벌 시장에서 바이오시밀러 개발 및 판매에 있어 최고 수준의 전문성을 보유해 높은 시너지를 창출할 수 있을 것으로 기대하고 있다”고 말했다.
또한 삼성바이오에피스는 미국에서 SB17에 대한 품목 허가 과정을 진행 중이다. 통상 바이오시밀러 개발사는 오리지널사와 특허 합의를 통해 제품 출시 시점을 조율하는데 삼성바이오에피스는 오리지널사인 얀센과 내년 2월 22일부터 출시할 수 있도록 합의한 상태다.
이는 셀트리온(내년 3월)이나 동아에스티(5월)에 비해 1~3개월 빠르게 시장에 진입할 수 있음을 의미한다.
셀트리온은 식약처로부터 지난 13일 해당 바이오시밀러 CT-P43인 ‘스테키마’의 품목허가를 받았다. 미국과 유럽에서도 지난해 허가 신청을 마쳤다.
또한 셀트리온은 미국 제약사 라니 테라퓨틱스(Rani Therapeutics)와 경구형 우스테키누맙 RT-111을 개발 중이다. 현재 스텔라라는 정맥주사(IV)와 피하주사(SC) 제형으로만 돼 있어 경구용 제제에 대한 수요가 크다.
셀트리온은 라니 테라퓨틱스의 경구용 캡슐 플랫폼 기술 ‘Ranipill'을 이용해 소장에서 혈관으로 주사제와 유사하게 약물을 전달할 수 있도록 설계했다. 현재 임상 2상을 준비 중이다.
셀트리온 관계자는 “스테키마뿐만 아니라 CT-P43의 미국·유럽 허가 이후 출시 계획에 맞춰 차질 없도록 준비하겠다”고 밝혔다.
동아에스티는 스텔라라 바이오시밀러 DMB-3115의 글로벌 진출에 초점을 맞추고 있다. 주요 국가인 미국과 유럽 외에도 사우디아라비아와 캐나다에 품목 허가를 신청한 상태다. 또 내달 중으로 품목 허가를 위한 EMA와 FDA의 생산 시설 실사가 진행될 예정이다.
동아에스티는 올해 품목 허가를 목표로 하고 있다. 현재까지 자산화 된 DMB-3115의 연구개발비는 400억 원에 달한다. 다만 국내 허가에 대해선 아직 검토 단계로 신중한 입장을 보였다.
[소비자가만드는신문=정현철 기자]



